非遺伝性ミオパチー
非感染性炎症性ミオパチー
9.その他の炎症性筋症
(1) 肉芽腫性筋症( Granulomatous myopathies including sarcoid myositis )
巨細胞をともなう非乾酪性類上皮細胞性肉芽腫を全身に形成するサルコイドーシスの一分症として筋に発生するものをサルコイド筋症と呼ぶ一方、筋のみに肉芽腫を形成し他臓器に認めない例は狭義の肉芽腫性筋炎または筋症と呼ぶ。筋病理学的には両者を区別できないので、ここでは肉芽腫性筋症と表題を掲げた。
肉芽腫性筋症の病理像と臨床像は一様ではなく、肉芽腫とその周囲の限局的な炎症に限られる変化がある群と(Fig. 53)、強い炎症と筋線維の変性を伴う群に大別できる。
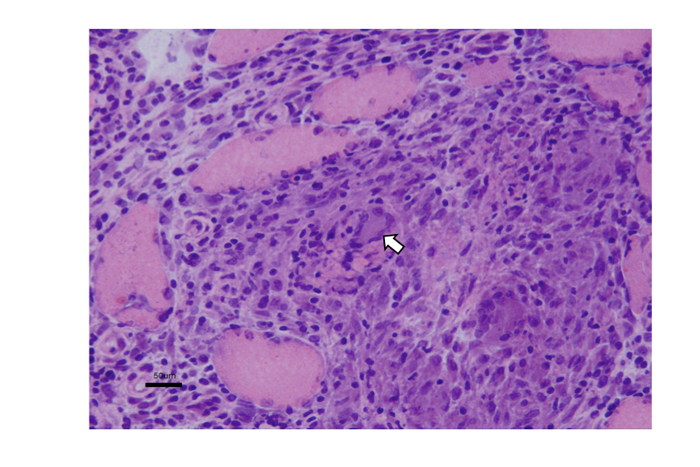
Fig.53
サルコイド結節を示す肉芽腫性筋症例: Langhans 型巨細胞(矢印)と多数の類上皮細胞が非乾酪性肉芽腫を形成している。筋細胞がその間に残存している。
前者では全身のサルコイドーシスに伴う例で多く、変性筋線維は肉芽腫の周辺に見られる程度だが、後者では筋炎におけると同様炎症細胞により広い範囲で筋変性を示す所見がある。後者の筋炎型にも急性・亜急性の経過のものと、慢性の例があり、好酸球の浸潤がある場合はトキソプラスマなどの寄生虫感染との鑑別が必要である。
(2) 局所性筋炎( Focal myositis )
局所性筋炎の病因は様々だが、中核となるのは側頸部をはじめとする頭頸部や四肢の、時に有痛性の腫瘤形成とともに発熱などの全身症状をともなう病態である(Cain, 1998)。成人が主だが、小児にも発生しうる。筋病理学的には、筋線維の変性と再生に加えて、マクロファージとリンパ球の局所の浸潤がみられ、間質の線維化を伴うことがある。ステロイドが奏功する例が多い。少数だが、好酸球の浸潤を見る例や、神経原性の変化を伴う例が報告されている(Auerbach, 2009)。また局所から始まり、後に多発筋炎を発症する例が報告されている(Heffner, 1981)。高齢者で首下がりがおきる後頸部の筋力低下にはいろいろな原因が知られているが、筋生検で炎症が見いだされたことから局所性筋炎として報告されている例がある(Kastrup, 2008)。
(3) 好酸球性筋炎( Eosinophilic myositis )
好酸球の筋内への浸潤を伴うミオパチーには多数の種類があり、様々な病態の集合である(Kaufman, 1993)。寄生虫感染、薬剤などの中毒、筋内にはあるが筋線維とは異なる血管炎(Selva-O’Callaghan, 2014) や筋膜炎、などの原因が特定できるものを除外したものを本態性好酸球性筋症と呼ぶ。全身の好酸球増多症候群(HES)を伴うものと、伴わないものがある。また局所筋炎の形をとる比較的良性の経過をとるものが少数報告されている(Kobayashi Y, 2001)。またHESと発熱などの全身症状に、筋痛と筋力低下を伴い、末梢神経や心筋障害をともなう亜急性の経過をとる例(Layzer,1977) が報告されている。
(4)移植片対宿主病(Myositis due to graft versus host disease)
筋炎と筋膜炎は同種造血幹細胞移植後の慢性移植片対宿主病の中で発生頻度は比較的低いとは言え、移植の絶対数の増加に伴い、重要な臨床的課題である。本邦の調査では欧米よりも少なく、移植後5年以内の発生率が筋炎と筋膜炎ともそれぞれ約0.55%であった(Oda, 2009)。筋炎と筋膜炎は併発することがあり、筋膜炎による皮膚の肥厚、オレンジ色の変色、関節拘縮などを認識することが必要である。筋炎は前腕などが障害されやすいなどの違いはあるものの、多発筋炎と類似する点が多い。特に筋病理学的に筋線維周辺にCD8+T細胞が浸潤することを含めて類似性が高いことが指摘されている(Parker,1996; Stevens, 2003)(Fig. 54)。
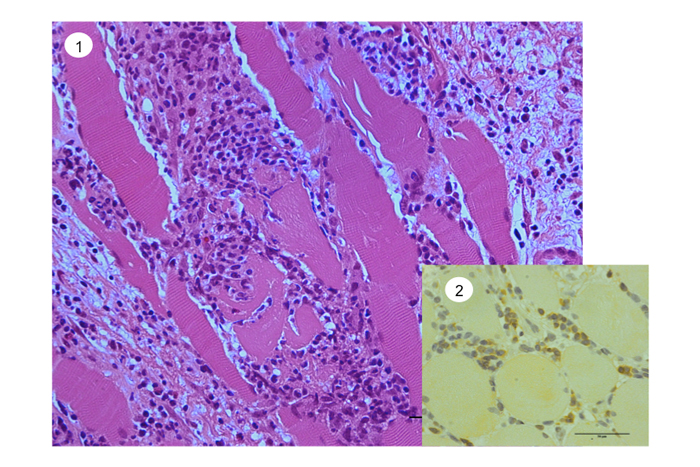
Fig.54
GVHD に見られた筋炎:強い細胞浸潤と筋線維の変性像をみる。浸潤細胞には比較的CD8陽性T細胞が多数
観察される。
① HE, ② CD8+ cells
診断には、他のGVHDの徴候の有無は重要であるが、筋炎が単独で発生することもある。MRIと、その所見で疑われる部位の筋および筋膜の生検が確定診断には有用である。治療としては早期に発見、診断して、副腎皮質ステロイドや免疫抑制剤等を使用することが試みられている。
(5)免疫チェックポイント阻害剤による筋炎(PD-1ミオパチー)
免疫チェックポイント阻害剤はその有効性で癌免疫療法に大きな変化をもたらした。しかし副作用があり、その中に筋炎が含まれる。筋炎は最初の薬剤使用時から平均約1ヶ月後に、筋力低下や高CK血症で明らかになることが多い、また重症筋無力症を併発することも少なくない(Seki, 2019)。
筋病理では散在する筋線維の壊死などの変性と細胞浸潤を示す病巣が見られる。浸潤細胞にはCD8+, CD4+細胞、マクロファージ、B細胞などが出現する。また筋細胞表面には MHC class I 抗原の異常な表出が見られる。
(6)血管炎
血管炎は炎症をともなう血管損傷を特質とする臨床的・病理的な病態の総称で、一次的な血管炎と他の疾患に伴う二次的な血管炎に大別できる(Harrison’s Principles of Internal Medicine, 20/E)。血管炎のほぼすべては骨格筋にも認められる。分類にかかわらず、血管にともなう筋の病理変化には共通点が多く、血管炎の存在を病理学的に認めることは可能な一方、その原因を形態のみから同定することは必ずしも可能でない。本稿では比較的頻度の高い二つの病態を提示する。
i) 血管炎
結節性動脈炎 (PN) と顕微鏡的血管炎 (MPA) では小ないし中径の血管が主に障害されるが、両者の病理的な判別は必ずしも容易ではない。MPA では毛細血管に小静脈に病変が及ぶことがある。血管壁は肥厚し、細胞浸潤やフィブリノイド変性が起きやすい。Elastica van Gieson 染色などで弾性板の形状を観察することにより、血管壁の構造的な破損の有無を確認することができる。PNの急性期では血管壁内に多形核好中球が出現することがあるが、慢性期に移行するにつれリンパ球が主体となる。程度は様々だが血管周囲を中心に細胞浸潤が認められる。筋線維の変化はふつう限定的だが、重症例では壊死線維もみられる。Type 2 線維萎縮は通常にみられる。筋束周囲の筋萎縮 (perifascicular atrophy) を見るのは例外的である。また病変のある血管や細胞浸潤近傍の筋線維表面にMHC class I 抗原の異常発現を見ることが多い。
ii) 好酸球性多発血管炎性肉芽腫症( EGPA, チャーグ・ストラウス症候群)
EGPA は喘息、末梢血および組織の好酸球増多、血管周囲の肉芽腫形成、および他臓器における血管炎を特質とする病態である。病理学的には小から中径の血管、静脈と小静脈を障害し、周辺に好酸球浸潤と肉芽腫形成を特徴とする血管炎がみられる。血管にはフィブリノイド変性が見られやすい。好酸球の浸潤が見られること除けば、筋線維の変化は他の血管炎とことなるところはない。




