非遺伝性ミオパチー
非感染性炎症性ミオパチー
病原体以外の原因で発生する炎症性ミオパチーには免疫性、薬剤性、中毒性などがある。非感染性炎症性ミオパチー(冗長を避けるために、この項では以下、非感染性と断らず炎症性ミオパチーと記載する)の中核をなすのは多発筋炎、皮膚筋炎、封入体筋炎であるが、それらの病態の少なくとも一部に免疫学的機序が関与すると考えられている。免疫性炎症性ミオパチーの中にはそのほか、膠原病、アレルギー疾患、肉芽腫性性疾患、悪性腫瘍に伴うものなどが含まれる(Matsubara, 2016a)。
炎症性ミオパチーの分類は現在なお流動的だが、表にまとめ(Tab.4)、主なものについて述べる。
炎症性筋症の分類
- polymyositis(PM):多発筋炎
- Dermatomyositis(DM):皮膚筋炎
- Amyopathic dermatomyositis:無筋症型皮膚筋炎
- Childhood dermatomyositis:小児皮膚筋炎
- Anti-synthetase syndrome induced dysimmune myopathy:抗合成酵素抗体関連筋症
- Overlap syndrome:オーバラップ症候群
- Non-specific myositis:非特異的筋炎
- Cancer associated myositis:悪性腫瘍合併筋炎
- Immune-mediated necrotizing myopathy:免疫性壊死性筋症
- Anti-signal recognition particle(SRP) antibody associated necrotizing myopathy
:抗SRP抗体関連壊死性筋症 - Anti-HMGCoA reductase(HMGCR) antibody associated necrotizing myopathy
:抗HMGCR抗体関連壊死性筋症 - Inclusion body myositis(IBM):封入体筋炎
- Other inflammatory myopathies
- Granulomatous myopathies including sarcoid myositis
- Focal myositis
- Eosinophilic myositis
- Myositis due to graft versus host disease
Tab.4
非感染性炎症性筋症の分類
1.多発(性)筋炎(polymyositis)
長年臨床で使われてきたBohan and Peter(1975ab)の分類では、皮膚症状の有無にしたがって皮膚筋炎と多発筋炎(PM)が区別される。しかし皮膚症状を欠く炎症性筋症の病態の多様性が明らかになるに従ってPMの概念は変わる必要が生じた。いろいろな意見が混在する現状だが、本項では主に病理学的な所見に基づくPMについて述べる。
Arahata and Engel(1986)の観察に端を発して、Dalakas and Hohlfeld(2003)の診断基準(Tab.5,6), と欧州神経筋カンファレンス(ENMC)の討論(De Bleecker, 2015)に引き継がれている基本概念は、細胞障害性T細胞がMHC class I 抗原を細胞膜に表出した筋細胞を障害する病態がPMであるという見方である。彼らの診断基準では、PMの確定診断のために、筋生検とその免疫組織化学的な解析を必須とした(Tab.5)。
DalakasとHohlfeldによる炎症性筋症の診断基準(2003)
| 診断 | 多発筋炎 | |
| 確実 | 疑 | |
| ミオパチーによる 筋力低下 |
あり | あり |
| 筋電図 | 筋原性 | 筋原性 |
| 筋原性酵素 | 高(ときに正常の50倍におよぶ) | 高(ときに正常の50倍におよぶ) |
| 筋生検 | CD8/MHC-1複合を伴う一次性炎症があり、空胞はない | 広範なMHC-1の発現があるが、CD8陽性細胞浸潤や空胞はない |
| 皮膚病変または 石灰化 |
なし | なし |
CD8/MHC-1 複合:CD8陽性細胞浸潤とMHC-1発現を認める状態(松原註)
Tab.5
Dalakas らの PM の診断基準では細胞性免疫による細胞障害の証拠としてCD8+細胞と MHC class I抗原発現の存在が重要視されている。
このため、一般のクリニックでの実施が困難であった。また検査態勢が整っていても、通常の筋生検の方法では細胞浸潤のある部位が観察される頻度が高くないこともあり、PMの確定診断例は少数に限られる結果になった。免疫組織学的な所見がPMと封入体筋炎(IBM)で共通点が多く、臨床的にも病理学的にも両者の鑑別が困難な例が生じたことも課題として未解決である。我々は筋生検前にMRIでできる限り炎症の局在部位を推定し、その部位を生検するMRI-orientated muscle biopsy(MOMB)を実施している(Fig. 41)。

Fig.41
筋炎の組織学的診断にあたっては炎症のある部位を補足することが重要なので、我々はMRI-orientated muscle biopsy(MOMB)を実施している。脂肪抑制T2weighted image上で炎症を示唆する高信号部位をあらかじめ計測して、体表上で場所を同定して、その部位を生検する。
PMでは炎症細胞浸潤とともに、筋線維の壊死をふくむ変性と、再生がみられる。炎症細胞浸潤はendomysiumとよぶ筋束内に主に見られ、筋線維表面に密着して取り囲むような像や、筋線維内に入り込んでいる像がしばしば観察される (Fig.42)。
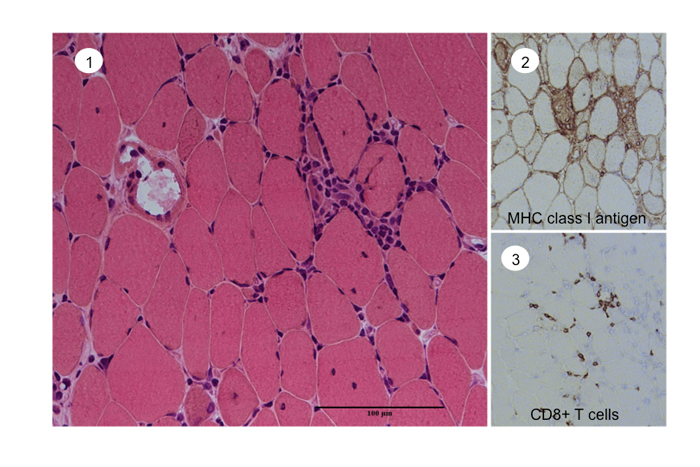
Fig.42
多発筋炎では筋束内で筋線維を取り囲むような細胞浸潤が観察され、MHC Class I抗原の aberrant expression が筋線維表面に広く認められる。浸潤細胞にはCD8+T細胞が出現している。
① HE ,② MHC class I antigen, ③ CD8+ cells
診断基準では非壊死線維にCD8+T細胞が密着していることと、同時に筋細胞表面にMHC class I 抗原の異常発現 (aberrant expression ) が見られること(CD8/Class I complex)が重要とされている。MHC class I のaberrant expressionは通常殆どすべての筋線維に瀰慢性に強く見られるので、二重染色でCD8とclass Iを調べる必要は必ずしもないが、CD8+細胞が密着しているのが壊死線維か否かは判断が難しい例がある。ましてCD8+細胞が非壊死線維に侵入していることを厳密に証明するには電子顕微鏡の免疫組織検査が必要である。このようなことは研究室のレベルでも容易ではない。現実的には隣接切片のHE染色像やマクロファージの筋線維内の浸潤から壊死線維と判断するが、完璧な方法ではない。電子顕微鏡では浸潤細胞が筋基底膜に接するのか、筋基底膜と形質膜の間に侵入するのかには差があるが(Fig. 43)、光顕のレベルでこの区別は不可能である。
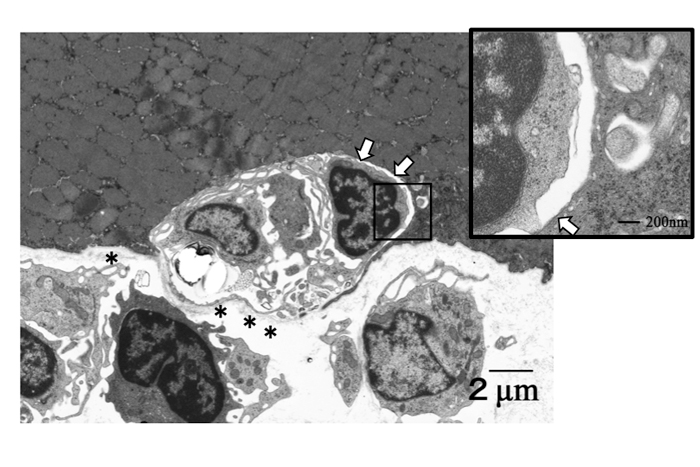
Fig.43
多発筋炎の電顕像:単核細胞が筋細胞の基底膜(*)の内側に浸潤し、筋細胞に形質膜(矢印)に密着している。
浸潤細胞にはCD8+細胞、マクロファージ以外にCD4+細胞も含まれていることが多い。CD4+細胞の多寡について診断基準は規定していない。CD4+細胞はT細胞の制御をするもので、Th1とTh2細胞のいずれをも含んでおり、その多寡のみで病態を論ずることは困難といわなければならない。




