遺伝性ミオパチー
筋ジストロフィー
ミオパチーのなかでも遺伝性で進行性があきらかなものを筋ジストロフィーと呼んでいる。
しかし後述する、遺伝性でありながら進行性がめだたない疾患群である先天性ミオパチーとの境界は必ずしも明確ではない。筋ジストロフィーの中にも進行の遅いものもあれば、先天性ミオパチーの一部には症例によっては進行性がめだつものが存在するからである。
1.Duchenne型筋ジストロフィー(DMD)
(1) 病態
ジストロフィンは筋細胞膜の裏打ちをする細胞骨格蛋白の一つで、細胞膜直下に存在する427KDaの蛋白質である。ジストロフィンをコードする遺伝子はX染色体短腕(Xp21)にある2.5メガベースという巨大遺伝子で、79のエクソンを持っている。筋細胞、脳皮質神経細胞、小脳プルキンエ細胞、グリア細胞、シュワン細胞など細胞により異なるアイソフォームがある。
筋細胞で、ジストロフィンは細胞膜の内側にあるが、一様ではなく、コスタメアの中でもI帯の近傍に多く分布する。ジストロフィンのN端はF-アクチンに結合し、これを介して収縮蛋白を細胞膜に結合させる構造の一部を形成している。ジストロフィンのC端はいわゆるジストロフィン結合蛋白複合体(dystrophin associated protein complex)に結合し、これを介して細胞膜貫通蛋白と基底膜支持蛋白にいたる、いわゆる dystrophin axis を形成する。これらの構造は、筋細胞表面の形状を保って保護し、収縮と弛緩により力を発生させ、これを骨、関節に効率的に伝えるという筋細胞本来の作用に重要な役割を果たしている。
ドゥシャンヌ(Duchenne)型筋ジストロフィー(DMD)およびその allelic な病態(同じ遺伝子の異常による異なる病態)であるベッカー(Becker)型筋ジストロフィーでは、ジストロフィン遺伝子の部分欠損(2/3)、塩基置換(1/3)と重複(少数)により、ジストロフィンの欠損および部分欠損または不完全形成がおきる。特にエクソン44と、エクソン2から7の間の2部位が変異の起こりやすいホット・スポットである。このため、細胞膜に脆弱性が生じ、破綻しやすくなり、そのため細胞外液の流入による細胞内環境の変化、とくにカルシウムの流入による異常な筋収縮や蛋白分解の亢進により、筋細胞の変性、破壊が続くと考えられている。
(2) 症状
2歳ないし4歳で発症する。立位と歩行ができるようになった後、転倒しやすい、ジャンプができないなどの症状に気づかれることが多いが、処女歩行の時期の遅延や乳児検診における運動能力の発達不良として早期に発見されることもある。その後進行して10歳台の前半で歩行不能、同後半で呼吸障害があきらかになり、20歳前後で呼吸不全となる例が多い。心筋障害には個人差が多いが、予後に大きな影響がある。また一部に知能障害を合併することがある。症状は四肢近位筋および躯幹筋の筋萎縮と筋力低下で、翼状肩甲 (Fig.10)、登攀性起立 (Gowers徴候)(Fig.11)、腰椎前弯、動揺性歩行、下腿筋の仮性肥大、アキレス腱の短縮などの症状がみられる (Fig.11)。
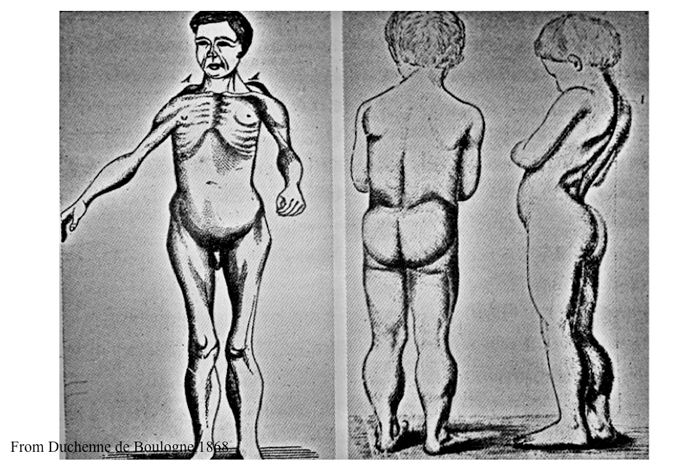
Fig.10
Duchenne によるイラストでは近位筋萎縮、仮性肥大、翼状肩甲、脊椎の前弯が強調されています。
# Duchenne ’ s original case, showing marked calf enlargement and lumbar lordosis.
(From Arch. Cén. Méd. Vol. 11, p. 8 (1868)

Fig.11
幼児の診察に役に立つ登攀性起立とよばれる、自分自身によじ登るような起立の仕方、Gowers 徴候。
#Sir William Richard Gowers (1845-1915)
検査成績は血清中の筋逸脱酵素(クレアチンキナーゼ:CK,アルドラーゼその他)の異常高値をみとめる。筋電図では筋原性の変化がみられる。遺伝子解析でDMDの約80%に異常を見いだす。
(3) 診断
上記の特徴的な発症のしかたと症状から通常に診断は容易であるが、確定のために遺伝子解析を行う。なお非定型的な点があり、診断に疑いのあるときには筋生検のうえ、ジストロフィンテスト(後述)で免疫組織化学的にジストロフィンの欠損またはBMDの例では減少が見られるか否かを証明する。母や女性の同胞・親族に関する保因者診断は、診察、血清CK活性、筋電図、遺伝子解析やジストロフィン・テストなどで、かなりの精度で可能であるが、実施にあったっては、倫理的配慮が必要である。
(4) 筋病理
ミオパチーの所見、すなわち筋線維横断面の円形化、中心核の増加、間質の開大がみられる。また間質の線維化および脂肪沈着がめだつことが多い(Fig.12)。
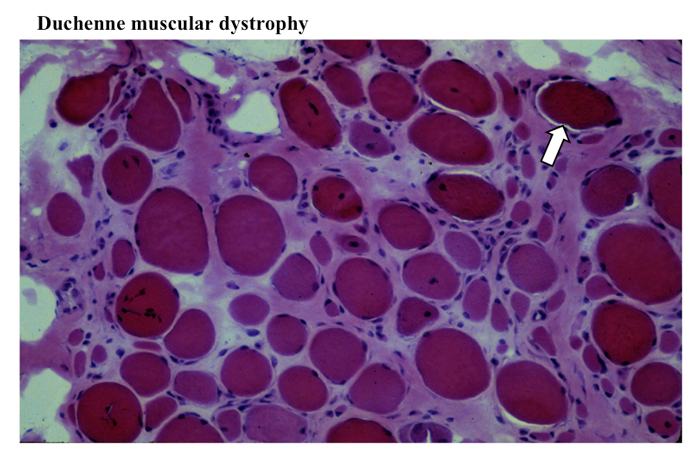
Fig.12
Duchenne型の筋ではミオパチーの所見、すなわち筋線維の大きさが小さいものから正常なものまでみられ、筋線維の横断面は円形化し、内在核が増加し、間質がひろくなり、そこに線維化と脂肪沈着が見られる。またDuchenne型ではよく過収縮、hypercontraction、を起こして濃く染まるopaque fibre (矢印)が見られる。
壊死線維、再生線維ともに多数見られる。HEとTCで筋形質が強染する横断面が円形の線維が散見されるが、これは過収縮状態の線維で opaque fiber と呼ばれる。進行した例では筋線維の脱落にともなう減少が著しく、数本の線維が線維化と脂肪化の強い間質の所々に、離ればなれの島状に残存するのみの状態となる。
組織化学的にはmoth-eaten fiber やミトコンドリア酵素の subsarcolemmal hyperactivity などの非特異的な筋線維の内部構築の異常が時に見られるが、筋ジストロフィーの他の病型や他のミオパチーに比較するとむしろめだたない。Fiber type に関してはtype 1 fiber predominance が見られることが多い。また再生線維を主とする type 2C fiber が出現する一方、type 2B fiber は同定しにくくなる例が多い。
(5) 免疫組織化学
ジストロフィン遺伝子は巨大な遺伝子であるため、免疫組織化学的な検査の精度を上げるため、異なるドメインに対する 2ないし3種類の抗体を使って検査するのが理想的であるが、遺伝子解析の精度が確立された今日ではルーチン検査として必須とは言えない。正常ではすべての筋線維の表面が染色される (Fig. 13)。
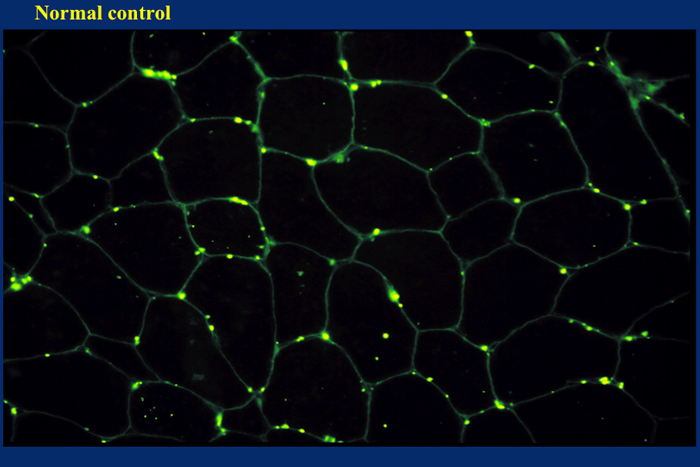
Fig.13
正常筋ではジストロフィン染色で筋線維表面に蛍光が見られる。
一方 DMD では染色されない (Fig.14)。

Fig.14
Duchenne型の患者では殆ど蛍光はみられず、ジストロフィンが欠損していることがわかる。
しかし少数の revertant fiber と呼ばれる線維がほぼ正常線維に近い染色性を示すことがある。その頻度は症例により異なるが、少数が群小を形成する例もある。Revertant fiber はエクソン・スキッピングなどにより (Lu, 2000) いったん頓挫した reading frame が回復する、あるい追加の小規模な deletion など何らかの機構が少数の筋細胞で働いたためと考えられている。
保因者ではジストロフィンが不規則で細胞表面の一部のみに発現している線維が観察される (Fig.15)。
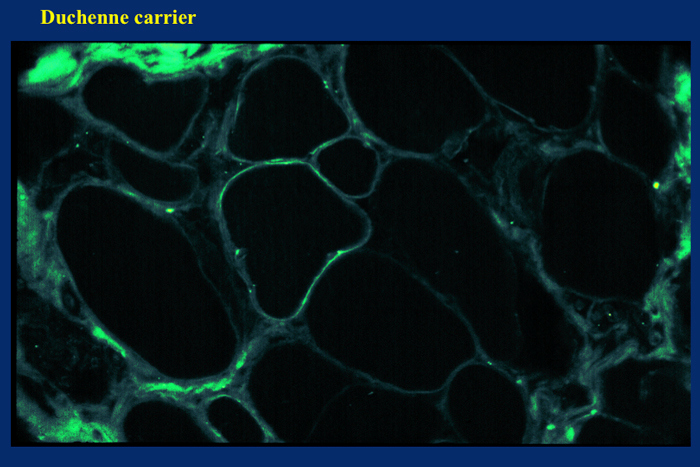
Fig.15
保因者の女性では正常なX染色体が産生するジストロフィンが部分的にみられます。ジストロフィンが欠損している部分の筋核では、Lyon 現象により、正常なジストロフィン遺伝子を持つX染色体の発現が抑制されている。
しかし、欠損の程度は症例により、また部位により異なるので、ほぼ正常に発現しているからといって、保因者であることを完全には否定できない。特に無症状の保因者ではジストロフィン欠損線維はまれである。一方、他の筋疾患で筋変性が強い場合は、ジストロフィンの染色性も消失または低下することが多いので、結果の解釈には、隣接切片の他の染色結果と対比するなどして、慎重を期す必要がある。 ユートロフィンで染色すると、ジストロフィン欠損部位に発現していることが多い。




